
|
|
|||||||
| شیمی در این تالار مباحث و مطالب مرتبط با علم شیمی گذارده خواهد شد |
 |
|
|
ابزارهای موضوع | نحوه نمایش |
|
#1
|
||||
|
||||
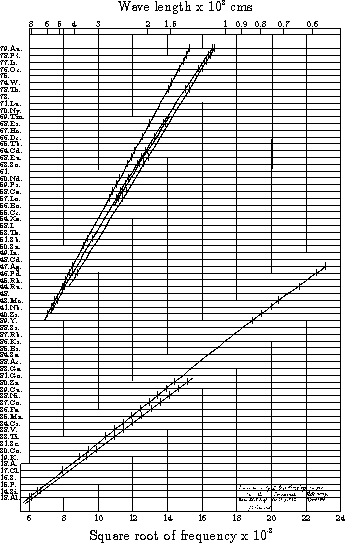
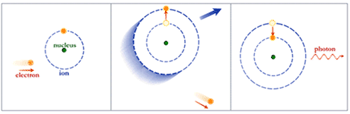
در سال ۱۷۸۰ ميلادي لاوازيه Lavoisier با كشف قانون بقاي جرم كه مي گفت : " جرم كلي مواد در واكنش شيميايي تغيير نمي يابد و جرم مواد اوليه با جرم محصولات برابر است." يك گام جديد در توسعه نظريه اتمي به پيش رفت.نظریه اتمی- بازگشت به نظريه اتمي در عصر جديد : به دلیل پیچیدگی فضایی و شکل نامناسب اغلب اربیتال های d , f ديرتر از حد معمول پر مي شوند ترتيب پر شدن اربيتالها به شكل زير است:دومين زير لايه كه داراي سه اربیتال است،زير لايه p ناميده مي شود. اربيتالهاي اين زير لايه در جهت محورهاي مختصاتي مانن يك دمبل شكل گرفته اند. اين زير لايه گنجايش ۶ الكترون را دارد.زير لايه سوم كه زير لايه d ناميده مي شود داراي ۵ اربيتال مي باشد كه در ۵ جهت از فضا گسترده شده اند و شكلهاي زيبايي دارند. اين زير لايه ظرفيت ۱۰ الكترون را دارد. همانطور كه ملاحظه مي شود اربيتال 4s زودتر از اربيتال 3d پر مي شود، به همين دليل نيز هست كه ما در تناوب سوم فقط ۸ عنصر داريم. در حاليكه انتظار مي رود در اين لايه ۱۸ عنصر داشته باشيم. ویرایش توسط SonBol : 10-09-2011 در ساعت 03:37 PM |
| کاربران زیر از ROJINAjoON به خاطر پست مفیدش تشکر کرده اند : | ||
| جای تبلیغات شما اینجا خالیست با ما تماس بگیرید | |
|
|
|
 |
| کاربران در حال دیدن موضوع: 1 نفر (0 عضو و 1 مهمان) | |
|
|
اکنون ساعت 01:41 PM برپایه ساعت جهانی (GMT - گرینویچ) +3.5 می باشد.















 حالت خطی
حالت خطی

